產品中心
試劑盒簡介:
本試劑盒利用硅羥基磁珠特異吸附核酸原理,配合特定的裂解緩沖液系統快速的純化樣本RNA。,廣泛地應用于動物組織。
該實驗可在一小時內完成,,整個純化過程不需要添加苯酚及氯仿等有毒試劑,提取的RNA可以直接用于PCR、Southern blotting等下游試驗。
實驗流程圖(資源處可下載):
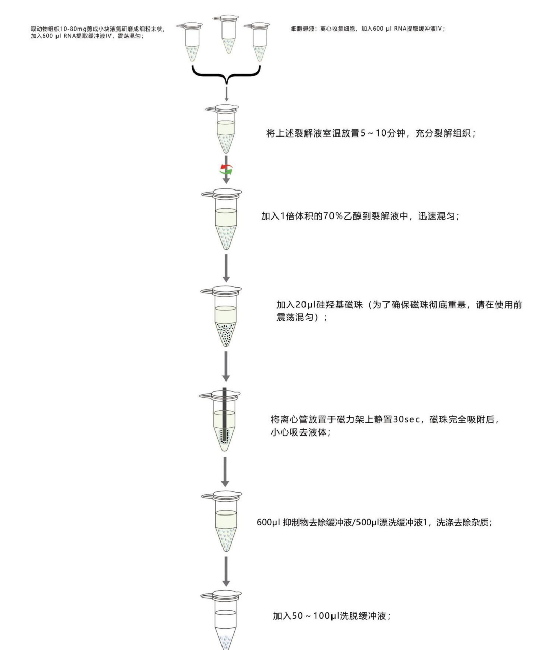
上一個:
下一個:
常見問題
一:RNA樣本篩選及儲存要點概述
RNA在細胞內極易降解,樣本選擇時一定要選取新鮮的樣本組織或者取樣后迅速低溫處理(液氮速凍);樣本出現多次反復凍融后,RNA得率會嚴重下降,也會導致RNA降解;RNA提取環境要保持無RNA酶污染;
二:(RNA)如何處理含有微量EDTA的Buffer EB在(RNA)試劑盒中?
試劑盒中Buffer EB(RNA專用)中含有少量EDTA,可能影響下游實驗,使用時適當稀釋,如果用其他洗脫液洗脫,要確保PH>7.5,PH過低影響洗脫效率;
三:(RNA)離心柱漂洗完成后操作注意事項
離心柱漂洗完成后,盡可能烘干柱膜上殘留乙醇,殘留乙醇會影響洗脫效率和下游實驗效果;柱膜也不建議過度干燥,沒有乙醇味道殘留最好,如果過度干燥可能影響RNA溶解;如果A260/230值過低,說明樣本提取過程中漂洗不徹底,有鹽離子殘留,建議增加漂洗次數;
四:RNA提取中A260/280比值分析:低于1.9的情況說明什么?
對于RNA提取,A260/280<1.9說明有可能存在DNA污染或者蛋白污染,如果洗脫樣本時沒有使用Buffer EB,而使用ddH20(確保無RNA酶),比值或偏低,因為Ph值會影響吸光值,并不表示樣本純度低;
五:如何判斷RNA的完整性
RNA完整性可以通過超微量核酸檢測儀檢測或者瓊脂糖凝膠電泳(電泳條件:膠濃度1%;1XTAE電泳緩沖液)來判斷;一般樣本RNA電泳條帶為兩條帶,對于植物樣本,有可能存在葉綠體RNA干擾,條帶數量大于4條,并不表示RNA提取發生降解;
六:如何有效防止RNA污染?
RNA容易受到環境污染導致RNA嚴重降解,建議實驗過程中注意更換實驗手套,使用所有耗材應該均無RNA酶的一次性耗材;
電泳環境受到RNA酶污染,也會造成RNA降解,電泳檢測不準確,確保電泳過程中電泳緩沖液,上樣緩沖液無RNA酶污染;
七:植物RNA樣本處理量差異的處理方案
對于植物樣本,樣本處理量無法統一確定,對于一般樣本(煙草,擬南芥等),提取量不超過100mg鮮重組織或者20mg干重組織,對于復雜樣本(水稻,玉米,榆樹等),建議初始樣本量不超過50mg鮮重或者10mg干重組織;如果需要較高的RNA量,可以采取多管濃縮的方法提取RNA;
如果離心時堵塞離心柱,建議減少初始樣本量;
八:植物RNA樣本提取試劑盒選型指南
RNA提取一般是傳統TRIzol方法和改進的柱式方法;對于TRIzol法進本可以提取大部分樣本RNA,但是對于多糖多酚植物樣本,建議使用者盡量選擇具有針對性的試劑盒(參見目錄),傳統TRIzol法無法有效去除多糖多酚這些次生代謝物;
相關產品
留言咨詢


