產品中心
試劑盒介紹:
自動化核酸分離純化方案是基于磁珠法原理提取生物樣本核酸,提取原理是利用納米磁珠對核酸樣本具有選擇吸附的特性,對混合樣本中的核酸有效富集,并通過凈化、裂解、漂洗、洗脫步驟,將核酸有效富集純化;有效富集的高純度核酸可以高效的應用下游試驗,包括核酸樣本的P 擴增、高通量測序等相關實驗;本公司系列試劑盒采用前處理過濾技術實現復雜樣本混合液凈化處理,再通過全自動化提取儀完成核酸富集。
實驗示意圖:
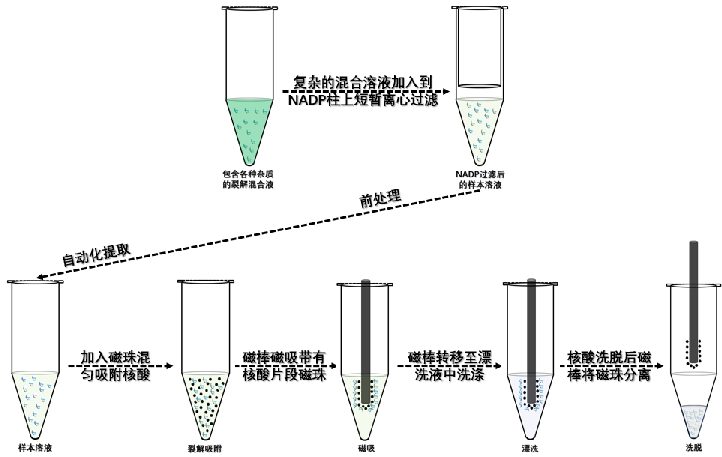
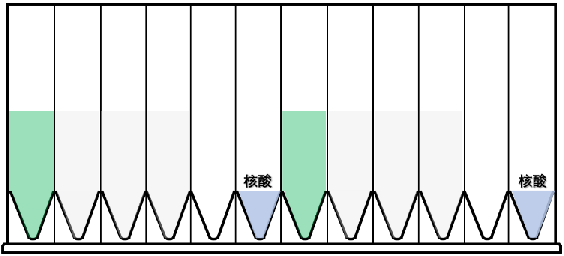
部分實驗案例:
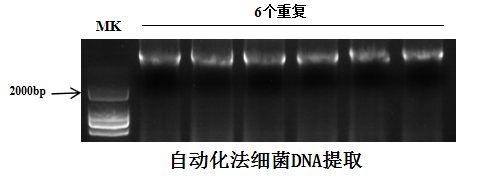
上一個:
下一個:
資 源
常見問題
一:(DNA)植物樣本處理量不確定問題的解決方案
對于植物樣本,樣本處理量無法統一確定,對于一般樣本(煙草,擬南芥等),提取量不超過100mg鮮重組織或者20mg干重組織,對于復雜樣本(水稻,玉米,榆樹等),建議初始樣本量不超過50mg鮮重或者10mg干重組織;如果需要較高的DNA量,可以采取多管濃縮的方法提取DNA;
二:(DNA)如何處理短時間內無法低溫處理的DNA樣本?
對于植物樣本,如果短時間不能低溫處理,建議使用硅膠顆粒干燥樣本,防止DNA嚴重降解;研磨處理材料過程中盡量不要過量,否則會導致DNA產量低;材料過量也會使樣本出現團塊無法裂解,導致離心柱堵塞,無法獲得高質量DNA;
三:DNA提取中A260/280比值波動是什么原因
對于基因組DNA提取,A260/280值如果低于1.7說明有可能存在蛋白污染,如果值大于1.9,說明可能存在RNA污染;如果洗脫樣本時沒有使用Buffer EB,而使用ddH20,比值或偏低,因為Ph值會影響吸光值,并不表示樣本純度低;
四:(DNA)離心柱漂洗完成后需要注意什么
離心柱漂洗完成后,盡可能烘干柱膜上殘留乙醇,殘留乙醇會影響洗脫效率和下游實驗效果;如果A260/230值過低,說明樣本提取過程中,漂洗不徹底,有鹽離子殘留,建議增加漂洗次數;
五:(DNA)試劑盒中Buffer EB含微量EDTA怎樣處理
試劑盒中Buffer EB中含有少量EDTA,可能影響下游實驗,使用時適當稀釋,如果用其他洗脫液洗脫,要確保PH>7.5,PH過低影響洗脫效率。
六:(DNA)基因組DNA樣本儲存需要注意什么
待提取樣本盡量避免反復凍融,否則會導致提取的DNA片段降解或者DNA得率嚴重下降。
七:血液樣本DNA提取注意事項
對于血液樣本,最好使用新鮮血液樣本或者4℃存放少于2天的樣本,否則會嚴重降低DNA產量;盡量避免反復凍融(不超過3-5次),每一次凍融都會降低DNA得率;
如果樣本中含有血塊,說明樣本收集時未加入血液抗凝劑;建議重新收集樣本并加入EDTA,肝素,檸檬酸等抗凝;在使用紅細胞裂解液處理血液時,確保血液樣本已經恢復到室溫狀態;處理過程中盡可能混勻樣本,防止紅細胞裂解不完全;
八:植物樣本DNA提取注意事項(一)
對于植物樣本,樣本處理量無法統一確定,對于一般樣本(煙草,擬南芥等),提取量不超過100mg鮮重組織或者20mg干重組織,對于復雜樣本(水稻,玉米,榆樹等),建議初始樣本量不超過50mg鮮重或者10mg干重組織;如果需要較高的DNA量,可以采取多管濃縮的方法提取DNA;
相關產品
留言咨詢


